豊富な実績と経験により、ゲノム編集株の作製をサポート致します
2018年の設立以来、ノックイン技術を得意分野とし、SNP変換によるiPS細胞の病態モデル細胞の作製、スクリーニングに用いるマーカー標識等で、私たちは150以上のプロジェクトを成功させています。
製薬企業出身という経歴と豊富な経験を活かして、ご要望に応じた柔軟なゲノム編集プラン・サービスを提供することが可能です。
実績
POINT-1
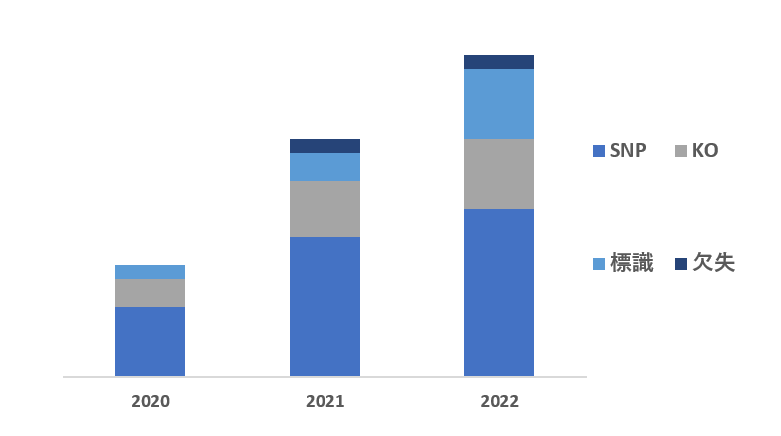
弊社に御依頼頂きましたゲノム編集の委託数は150件を超えています。グラフはその内訳の推移です。
増加する需要と多様化するニーズへの対応力で、受託件数が年々増加しています。
POINT-2
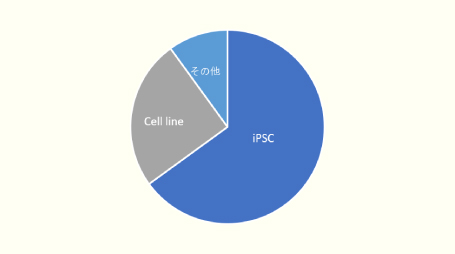
弊社に御依頼頂きましたゲノム編集の細胞実績です。
ご依頼いただいているゲノム編集は、過半数がiPS細胞によるものです。
武田薬品工業時代からiPS細胞でのゲノム編集にも従事していましたので、iPS細胞の取扱い経験も豊富です。
1塩基変異(SNP)細胞作製
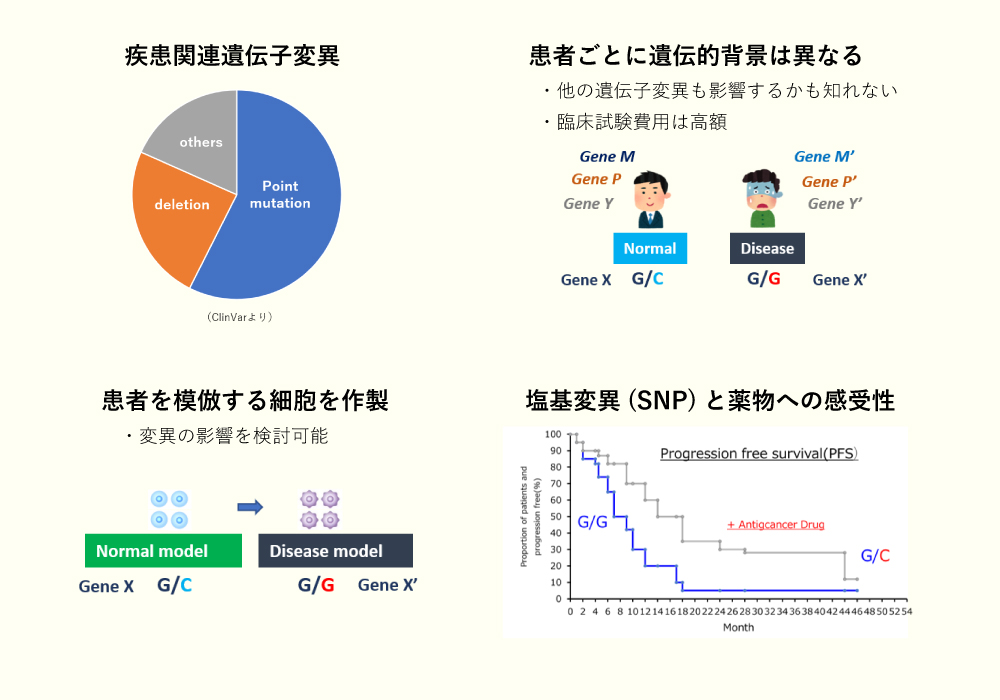
- 近年、ゲノムDNAの解析技術の進歩により疾患と遺伝子変異の関係性はよく調べられており、そのうち6割に1塩基置換が関与しています。
- 一方で、個々の疾患ごとに細胞サンプルを入手することは患者様への負担やコスト増を招きます。
- 病態を示さずとも、塩基変異(SNP)により薬物の効果が異なることがあることが知られており、分化全能性を示すiPS細胞でゲノム編集による病態モデル細胞を作製しておくことは、創薬研究の初期で欠かせないツールとなっております。
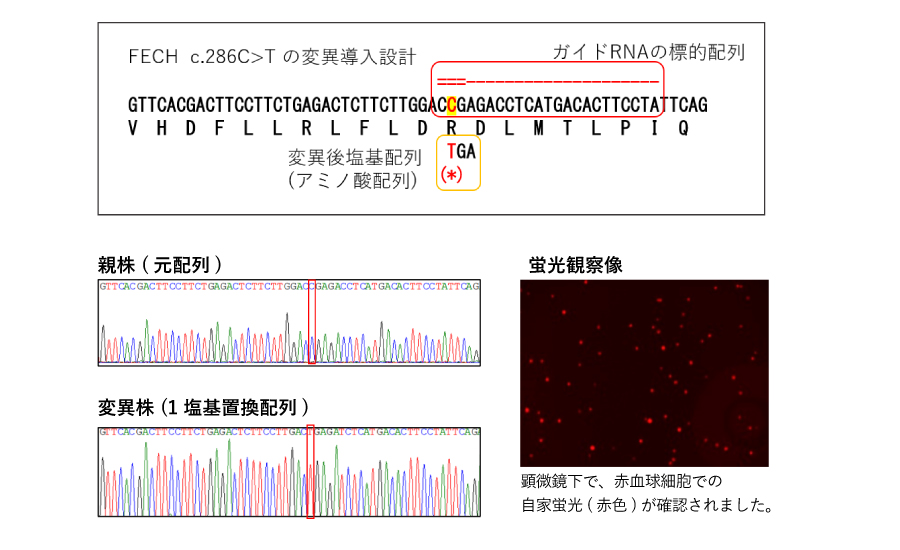
弊社実施の1塩基変異(SNP)細胞作製例
骨髄性プロトポルフィリン症(EPP)モデル細胞の作製
ヘム生合成系酵素の1つ: フェロキラターゼに点変異 (FECH c.286C>T) を導入することで、赤血球における自家蛍光 (EPPの診断基準の一つ) を確認しました。
ノックアウト(KO)細胞作製
- 遺伝子の機能を解析したいときには、遺伝子の機能欠失 (KO) 株を用いたコンセプト (PoC) 検証が用いられます。
- CRISPR/Cas9はその効率の高さから、ガイドRNAをしっかりと選定することで、一度に複数の遺伝子を効率的にKOすることが可能です。
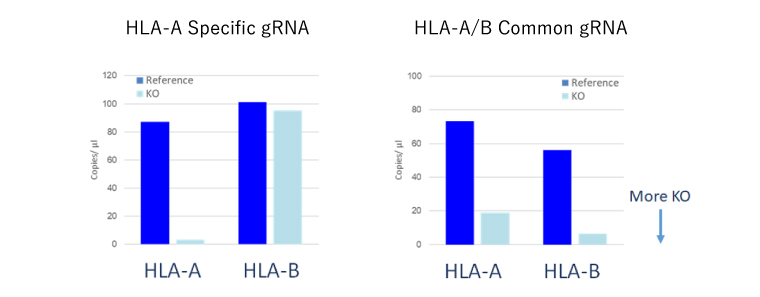
- 類似配列を有するファミリータンパク質の間でも、同時に、或いは個別にKOすることも可能です。
弊社実施のノックアウト細胞作製例
シンプル KO:効率的なターゲット遺伝子への変異導入株作製
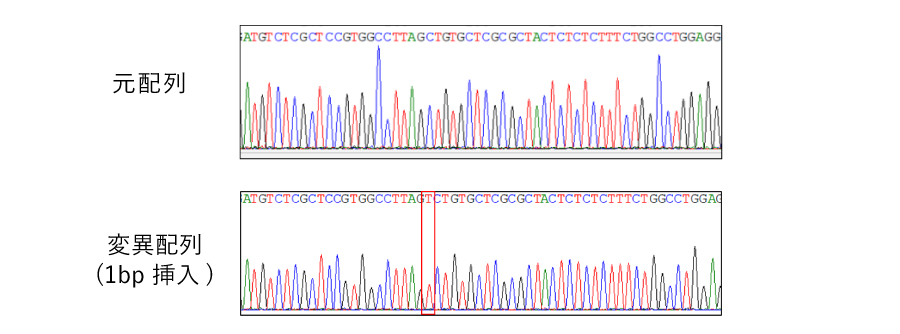
マルチプル KO:時間と継代数の節約
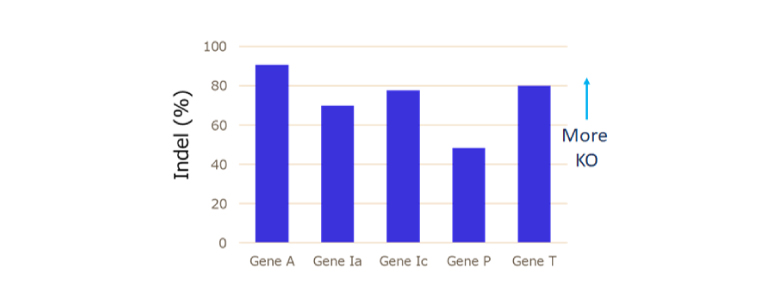
ファミリータンパク質のKO
誘導型KO
生命維持に必要な遺伝子をKOしたいとき、マウスモデルではFloxマウスが利用されます。これは細胞 (臓器) 特異的/時期特異的にKOを引き起こすことで、全身でKOしてしまうと致死となってしまう遺伝子でもKOによる解析が可能となる技術です。
iPS細胞を用いた分化研究に、あるいは任意のタイミングでKO細胞としたい場合に有用な方法です。

ノックイン型KO
CRISPR/Cas9によるKOは、その効率の高さからプールでも利用可能ですが、クローンも容易に取得できます。
しかしながら、個々のクローンはランダムな配列パターンであることから、クローン間でアミノ酸が異なるパターンとなるため、配列を揃えておきたい場合があります。
そのような場合には、ノックインの手法によりストップコドンを挿入することで取得クローンの配列を揃えることが可能です。
また、他の細胞株で試験するといった場合にも、同じ配列でKO株の作製が可能です。
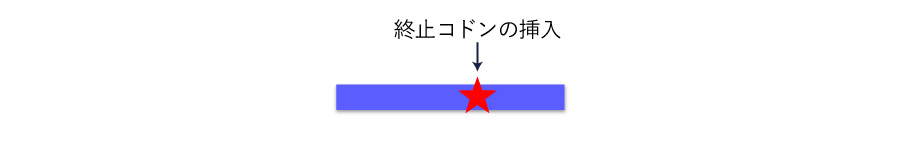
ノックイン 細胞(任意配列の挿入)作製
- 分化研究に用いるレポーターiPS細胞
蛍光遺伝子を分化マーカーに融合することで作製する分化レポーター細胞は、分化研究に非常に役に立つ細胞として利用されています。
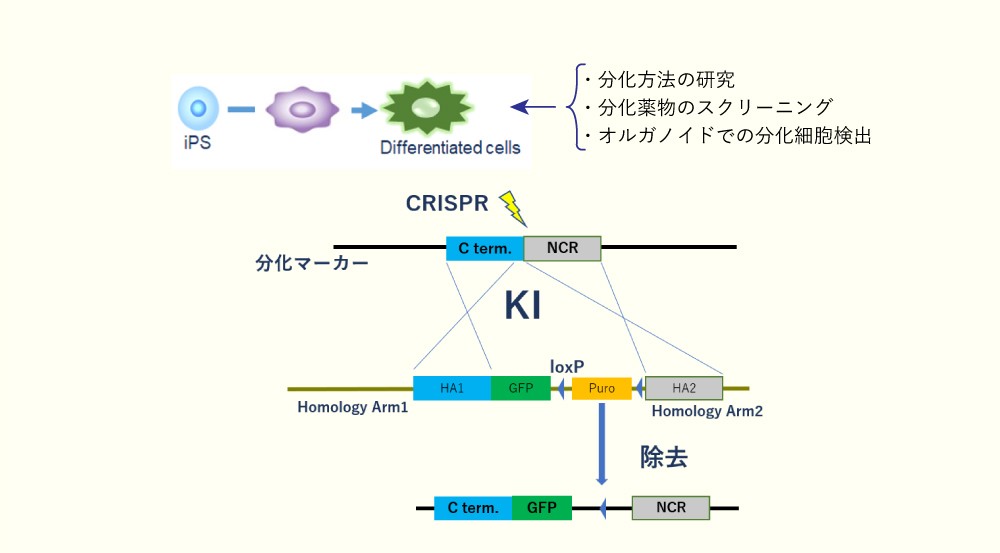
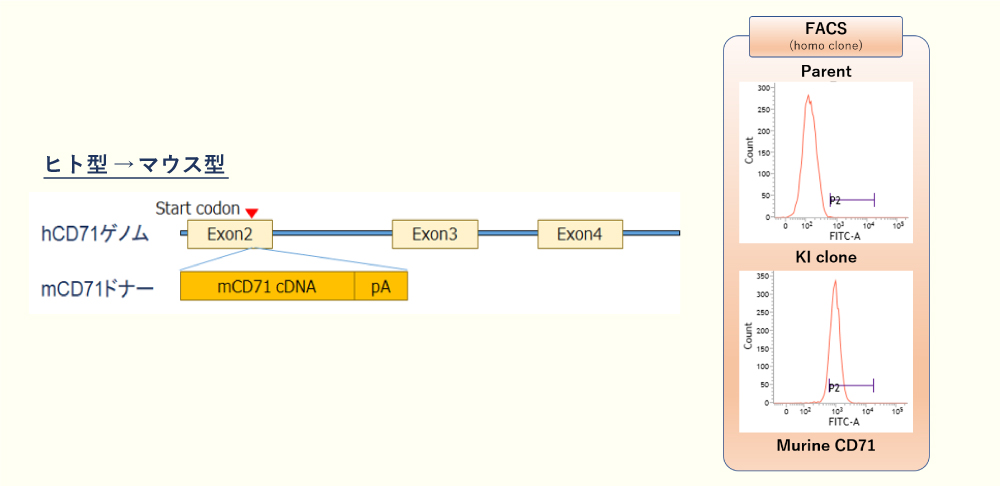
- 遺伝子の生物種変換
遺伝子の特定の座位に別種の遺伝子をノックインすることで、細胞が本来持つ遺伝子の生物種を変換することができます。
これにより、種差のある化合物を同じ細胞で評価することが可能になります。
GenAhead Bioの特徴
ゲノム編集細胞は多段階のプロセスにより作製されますが、その作業内容は目的に応じて調整する必要があります。

- 成功するゲノム編集デザイン
私たちは150以上のプロジェクトをこなした経験豊富なチームで、その内訳も、ノックアウト、マーカー標識、SNP変換と多岐に渡ります。デザインは経験が重要となる部分です。 - 目的に応じたデザイン
私達は該当する遺伝子の構造から機能まで調べます。どの部分を標的とすれば、お客様の実験の目的に適ったゲノム編集細胞になるかを考えます。 - ゲノム編集条件の調整力
自信を持ってデザインしたガイドRNAであるにもかかわらず、ゲノム編集細胞を取得出来ないという相談を受けることがあります。私たちは、非常に高効率でノックインした経験のあるガイドRNA、ドナー核酸を所有しており、この陽性対照ツールが、いつも通りゲノム編集に成功するトランスフェクション条件を設定しています。 - 成功可否の早期判定
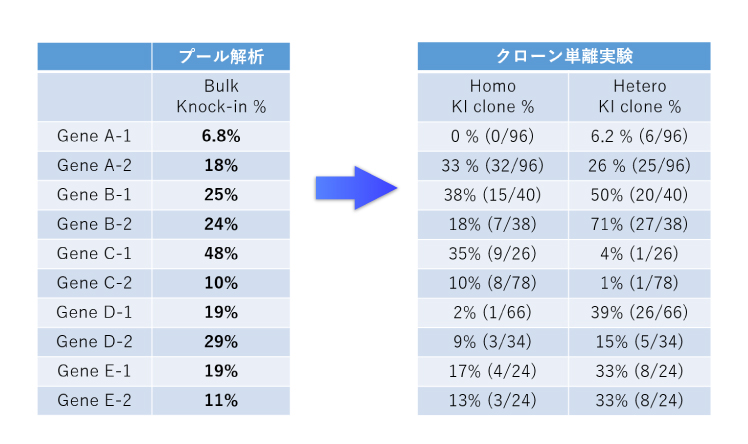
私たちは、ゲノム編集効率が非常に低い場合には、ゲノム編集の確認と定量(プール解析)にCRISPR-SNIPER法(ゲノム編集早期に、最終的なゲノム編集割合を高感度で選択的に定量する技術)を用います。これにより、早期に実験の成否を見通す事が可能となります。
プール解析の概要
- 従来、ゲノム編集の成否はクローン解析により初めて判定していましたが、それには数か月の期間を要していました。
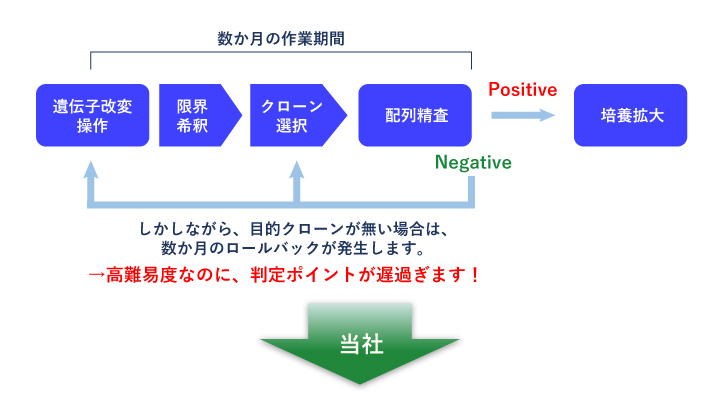
- 我々は、プール解析 (CRISPR-SNIPER) によるゲノム編集効率の定量化により、早期に取得見込みを判定する事ができます。
- また、ゲノム編集効率が低い場合には、これまでに蓄積してきた膨大な解析データ、ノウハウを条件の最適化に利用する事ができます。
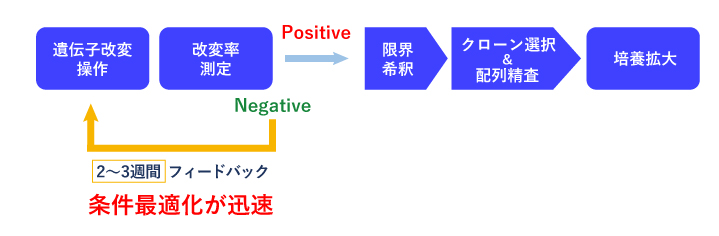
- これまでの150以上のクローン単離の実績から、シングルクローニングに進む際に、バルク細胞群のゲノム編集効率をもとにした確度の高い Go/No Go判定を御提案する事ができます。
ライセンス
- 弊社は、研究用として、ERS Genomics Ltd及びBROAD INSTITUTEとライセンス契約を締結しております。
- 弊社からの購入細胞では、internal research 以外に共同研究先や研究委託先での使用も可能です。
- 弊社にゲノム編集サービスを委託いただく場合は、Use and Limited Licenseをお読み頂くようお願い致します。
- Use and Limited License には、ERS Genomics Ltd及びBROAD INSTITUTE両社の特許を利用するための条件が記載されており、弊社にゲノム編集を委託頂いた場合は、本規約に同意頂いたものと理解させて頂きます。
株式会社リプロセルとの協業
iPS細胞分野のリーディングカンパニーである株式会社リプロセルと協業体制を整えております。iPS細胞をお持ちでなかったり、iPS細胞の樹立からご希望のお客様に対しても、リプロセル社で調達されたiPS細胞を用いたゲノム編集細胞を数多く提供させて頂いております。
詳細は、株式会社リプロセルの「iPS細胞ゲノム編集受託サービス(CRISPR/Cas9)(https://reprocell.co.jp/sniper-190416)」を参照頂くようお願いします。
